高血压性心脏病(HHD)指血压进行性升高施加于左心室的生物力学应力引起心肌反应而引起的心肌病,包括无症状的左心室肥厚(LVH)和临床心力衰竭。流行病学证据显示,HHD是导致人群中心衰风险增加的主要因素。而HHD日益增长的心衰负担表明医疗需求尚未得到满足,因此,需要基于心肌组织重构表型的创新诊断方法,以识别高危心衰患者,并进行个性化治疗,以逆转重构并防止向心衰转变。近期,Eur J Heart Fail发表的文章介绍了HHD的心衰负担、当前的病理生理学观点挑战及新兴诊断和治疗方法。
高血压性心脏病的心衰负担
➤心衰是一种全球性的流行病,随着人口老龄化、缺血性心脏病 (IHD) 治疗的改善以及延长心衰患者生存期的有效循证疗法的可用性,其患病率正在增加。
➤尽管全球范围内高血压的年龄标准化患病率稳定,但考虑到近年来高血压治疗控制率并不理想,高血压仍然是心衰的主要原因之一。
➤在过去二十年中,在射血分数降低(HFrEF)或射血分数保留(HFpEF)的心衰患者中,高血压的发生率有所增加。高血压患者(尤其是女性和老年人)患有心衰的终生风险高于血压正常的人群。另一方面,在包括193424例患者23项高血压试验中,新发心衰的发生率占报告的所有主要心血管事件的28.9%(n=7171)。因此,心衰仍然是高血压管理中的主要问题。
➤流行病学证据显示,HHD是导致人群中心衰风险增加的主要因素。
①HHD的全球年龄标准化患病率在过去30年中有所增加,特别是在女性和老年人中。
②在全球范围内,HHD是继IHD之后的第二大心衰患病原因。但在25-69岁的成人中,HHD在心衰所有患病原因中的所占比例最大。高收入地区与IHD相关心衰的人群归因危险度较高,但中低收入地区与HHD相关的心衰的人群归因危险度较高。
③2011年后,心衰和HHD的年龄调整死亡率较归因于其他心脏病亚型的心衰增长更快。
对当前HHD的病理生理学观点的挑战
➤既往HHD被认为是压力超负荷导致心肌细胞肥大,LVH进展,进而导致心功能不全和心衰的简单结果。事实上,包括30项超声心动图研究(包括37700例接受治疗和未接受治疗的高血压患者)的综述显示,尽管有慢性高血压,但约三分之二未接受治疗的患者无LVH。此外,一项对14项研究(包括12809例高血压患者)的荟萃回归分析发现,治疗诱导的LVH消退并不能预防新发心衰。
➤因此,有观点认为,在HHD患者中,导致其组织学重构的心肌组织改变可能会导致心功能、灌注和电活动的改变,从而增加心衰的风险(表1)。
表1 HHD的主要心肌显微病变及其主要细胞和分子决定因素

注:CCR2,C-C趋化因子受体2;VSMC,血管平滑肌细胞;VEGF,血管内皮生长因子。
➤肥厚心肌细胞的能量效率和机械应力下降,细胞凋亡增加,存活心肌细胞数量减少,都会影响高血压心脏的收缩功能。此外,弥漫性反应性间质纤维化(常伴有轻度血管周围炎症)增加了细胞外基质刚度,导致舒张期左心室压力增加和充盈受损,并限制了舒张期心肌细胞的拉伸,减少了收缩期心肌细胞的长度依赖性力产生。
➤从这个意义上说,在HHD和心衰患者的心内膜心肌活检中可观察到心肌细胞凋亡和I型胶原纤维间质沉积增加。有研究发现,细胞凋亡和纤维化的增加与不良的左心室重构相关,支持这些病变在亚临床HHD向临床表现心衰的转变中发挥潜在作用。
➤最近,高血压心脏中可能对心功能产生有害影响的冠状动脉血液和淋巴微循环的变化广受关注。除了功能性改变(例如,血管舒缩功能失调和内皮的促炎-促纤维化激活)外,在HHD患者中还发现了解剖学改变(例如,中膜厚度与管腔比增加,前小动脉和小动脉的最大横截面积减小,以及毛细血管稀疏导致的血管密度降低)。这些变化会使心肌成为永久性缺血组织,促使心肌细胞死亡和修复性纤维化,从而导致心衰。
➤Brown等人的研究支持了这一可能性,证明在接受正电子发射计算机断层扫描(PET)心肌灌注显像的无冠心病的HFrEF高血压患者中,低左心室心肌血流质量比(表明供需不匹配)与左心室质量较大、左心室收缩功能较差以及循环心肌肌钙蛋白T和I水平升高相关。有趣的是,在其他不良临床结局中,较低的左心室血流质量比与因新发心衰住院独立相关。
➤另一方面,心脏淋巴管生成不足和淋巴功能障碍可能会促进心肌水肿,并导致高血压心脏的炎症和纤维化。
➤HHD的特征是心肌重构,即间质纤维化(左心室、左心房均可发生)。左心房重构可导致房颤和心房收缩功能障碍,从而促进心衰的发生发展。右心重构可能独立于肺部疾病或肺动脉高压的影响而发生,并可能影响右心室和右心房功能。
➤因此,HHD涵盖了宏观LVH以外的一系列心脏改变,其特征是微小的心肌病变以及随后影响整个心脏的功能改变。这些改变的起源还必须涉及高血压作为影响心脏以外靶器官的全身性过程的典型机制(例如,由于主动脉和大动脉僵硬导致的心室-动脉解偶联)。
HHD的创新诊断和治疗方法
➤HHD日益增长的心衰负担表明医疗需求尚未得到满足。因此,HHD需要基于心肌组织重构表型的创新诊断方法,以识别高危心衰患者,并进行个性化治疗,以逆转重构并防止向心衰转变(图1)。
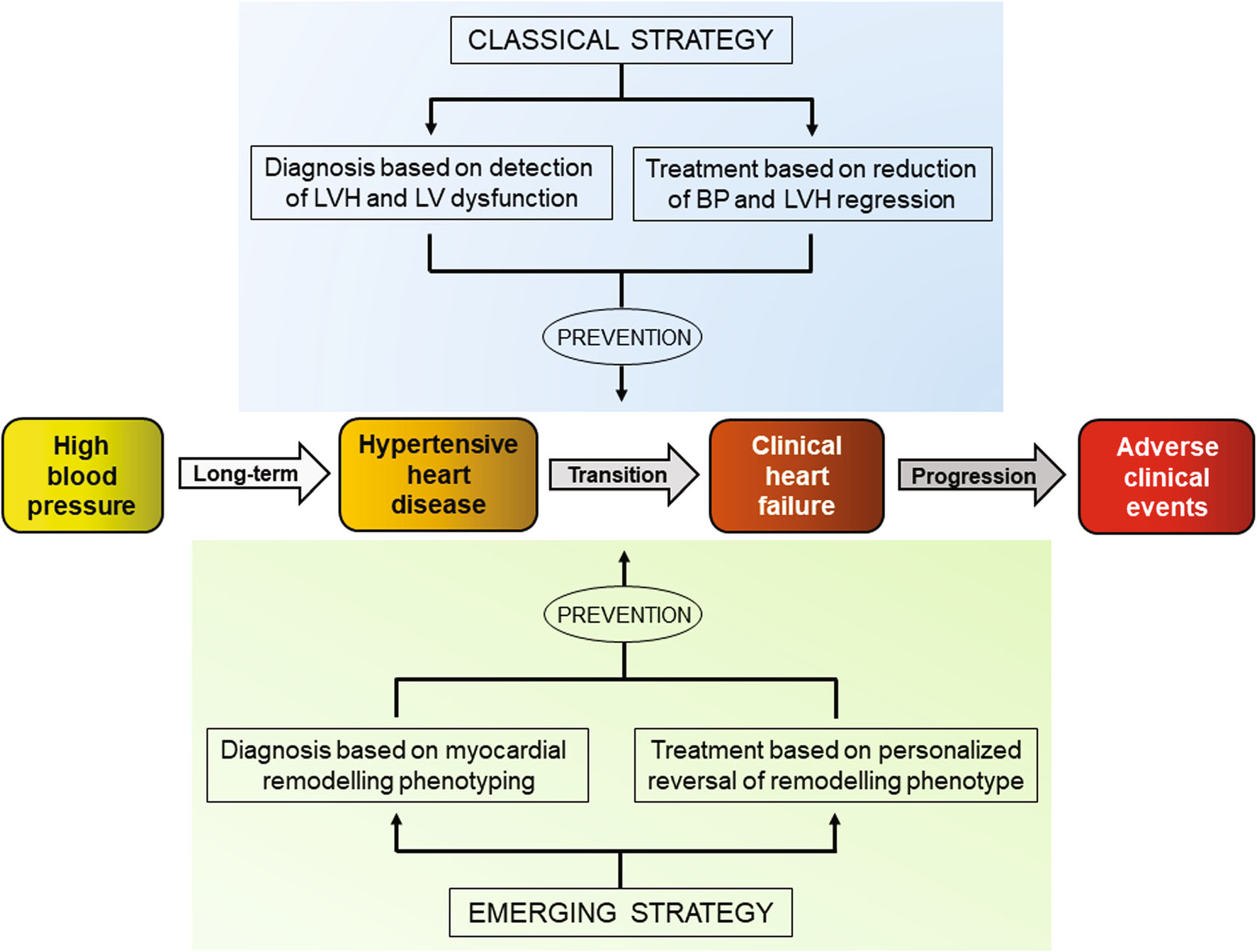
图1 预防HHD向心衰转变的经典和新兴辅助诊断和治疗策略
注:BP,血压;LV,左心室;LVH,左心室肥厚。
➤由于心肌重构不能通过心内膜心肌活检进行常规评估,因此有必要研究联合生物标志物的临床效果,包括识别重构心肌的分子和组织学特征的循环生物标志物(例如蛋白质、非编码RNA、代谢产物和/或表观遗传修饰),以及表征心肌组织特征的先进影像学生物标志物(例如,利用左心室应变、心血管磁共振成像[CMR],计算机断层扫描[CT]或心肌灌注PET评估的参数)。
➤近期,两项关于心肌间质纤维化的影像学和循环生物标志物的研究可能支持这种新方法。
√在无症状高血压患者中,非缺血性晚期钆增强(LGE)的CMR成像中的心肌间质纤维化与左心室质量较大、功能较差和循环中N末端B型利钠肽前体(NT-proBNP)水平升高相关。重要的是,非缺血性LGE也与不良结局相关,包括首次因心衰住院。
√另一方面,在有心衰风险的个体(包括超过78%的慢性动脉高血压患者)中,心肌间质纤维化的循环生物标志物(即血清I型前胶原羟基端肽[PICP])与左心室质量较大、左心室舒张功能较差和循环NT-proBNP水平升高有关。值得注意的是,螺内酯治疗后血清PICP的降低与左心室舒张功能障碍的改善有关(例如,舒张早期二尖瓣血流速度与舒张早期二尖瓣环运动速度比值[E/e'比值]降低)。
➤据推测,使用辅以机器学习和人工智能应用的多模式方法,将在HHD患者中识别具有异质性病理生理学的不同心肌重构表型,从而确定不同的心衰风险和治疗需求。为此,需要多国协作,提供同时评估生物标志物组合的大型独立队列,并开发和验证支持临床决策的算法。
未来展望
慢性高血压导致的心力衰竭是当今社会的最大威胁之一,并且未来将会加重。我们对HHD的总体理解仍不完全,因此,迫切需要进行转化研究,以更多地了解导致HHD患者心肌重塑的细胞和组织水平变化的机制。
此外,在未来的临床试验中,应根据HHD患者的重构表型分层,设计和评估多种生物标志物指导的个性化治疗策略,以预防此类患者发生心衰。

